检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ js6666金沙登录入口-欢迎你 / 学术科研
在真核生物中,染色质蕴藏的丰富表观遗传信息能够在细胞分裂过程中稳定的传承到子代细胞。亲本核小体携带的组蛋白翻译后修饰是表观遗传信息的重要组成部分。在DNA复制过程中,复制叉解组装前方的亲本核小体,解离的亲本组蛋白会被回收和递送到子链DNA上,完成新生核小体的组装。染色质领域对于亲本组蛋白回收的机制还缺乏直接的证据,现有的研究结果都相对片段化。基于已知的核小体分步组装模型,推测亲本组蛋白的回收机制可能也是分步完成:首先,回收的亲本(H3-H4)2四聚体和新生的子链DNA形成核小体前体,其次两组H2A-H2B二聚体再分别加载到 (H3-H4)2四聚体的两侧,生成完整核小体。目前已知的具有组蛋白结合活性的复制体组成因子都是选择性识别H3-H4,这一模型可以较好解释H3-H4所携带表观遗传信息的继承机制,但无法解释H2A-H2B携带的表观遗传信息是如何继承的,这也是困扰领域几十年的一个重要科学问题。
2024年3月6日,js6666金沙登录入口-官方入口、北大-清华生命科学联合中心高宁教授、李晴教授及合作者香港大学翟元梁教授、美国康奈尔大学戴碧瓘教授在Nature杂志最新一期发表题为“Parental histone transfer caught at the replication fork”的论文,对酵母内源复制体进行了结构和机制解析,捕捉到了亲本组蛋白回收过程中一个关键中间状态——组蛋白分子伴侣FACT与复制体因子Mcm2、Tof1协作捕获了解离后的亲本组蛋白亚复合物,表明亲本组蛋白可能以六聚体[(H3-H4)2-(H2A-H2B)]的形式回收,为理解复制偶联的亲本组蛋白回收机制以及表观遗传信息的传承基本单元提供了新的视角。
为了捕捉复制叉处亲本组蛋白回收的过程,本工作从酵母细胞中纯化了内源的复制体复合物,获得包括FACT、亲本组蛋白、复制叉保护复合物在内的复制体复合物,并进行了深入的冷冻电镜结构分析和分子机制解析(图1)。在捕获的复制体复合物中,亲本组蛋白以六聚体的形式存在,亲本DNA已完全剥离,其中一个H2A-H2B二聚体也已解离。FACT的Spt16亚基和复制体Mcm2亚基的组蛋白结合区域共同协作,以延展的形式、模拟DNA的结合方式缠绕在六聚体的侧面,维持了组蛋白亚复合物的稳定性。结构数据清晰的表明这一组蛋白六聚体是亲本核小体解组装之后的一个中间复合物,被复制体所识别和捕获。此外, Mcm2的N端结构域(NTE)和复制叉保护复合物Tof1亚基紧密互作,在复制叉前端构建了一个组蛋白六聚体的结合平台(图1),使得六聚体靠近滞后链DNA聚合酶的结合区域。基于这一发现,设计了相应的Mcm2和Tof1突变体,采用新生DNA测序eSPAN技术证明干扰Mcm2-NTE与Tof1的相互作用的确会严重影响亲代组蛋白回收和递送至新生滞后链DNA。
值得一提的是,这是国际上首次在DNA复制体的框架下展示亲本组蛋白回收过程的高分辨分子细节,揭示了FACT、Tof1、Mcm2等在这一过程的分子角色,为“亲本组蛋白回收”这一表观遗传重要概念提供了坚实的直接实验证据。更为有趣的是,该工作可能揭示了组蛋白回收的一种新的基本单元——六聚体,暗示着H3-H4以及H2A-H2B的表观信息在一次的传递过程中可以同时被子链继承,为全面揭示DNA复制偶联的表观遗传信息的继承奠定了重要的基础。
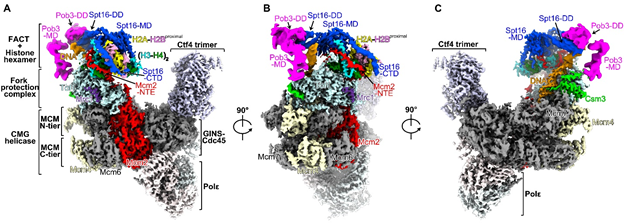
图1 酵母内源复制体复合物冷冻电镜结构
翟元梁教授、高宁教授、李晴教授、戴碧瓘教授为本文的共同通讯作者,北京体育大学李宁宁研究员、香港大学博士生高原、js6666金沙登录入口-官方入口博士生张煜婕、香港大学余大启博士(之前在香港科技大学)为本文的共同第一作者。香港大学李祥教授、刘杨教授、周钶达教授、林剑威博士、博士生李健、许志纯博士,香港科技大学党尚宇教授、张盈怡博士,北京体育大学冯建勋博士也参与了这项工作。本研究得到了国家自然科学基金、科技部重点研发计划、北京高等学校卓越青年科学家计划项目、香港研究資助局以及北大-清华生命科学联合中心、膜生物学国家重点实验室、蛋白与植物基因研究国家重点实验室的经费支持。香港科技大学生物冷冻电镜中心、北京体育大学高性能计算平台对本项目提供了重要的技术支撑,北京体育大学冷冻电镜平台、js6666金沙登录入口-官方入口仪器中心及国家蛋白质基础设施(北大分平台)也为本项目提供了重要帮助。